Granulozytenimmunologie
Bestimmung von Granulozytenantigenen
Derzeit unterscheidet man fünf Antigengruppen auf neutrophilen Granulozyten. Das erste granulozytenspezifische Antigen (NA1, heute HNA-1a) wurde 1960 im Zusammenhang mit einem Fall von Neonataler Immunneutropenie (NIN) von Lalezari beschrieben. Dieses Antigen liegt auf dem klinisch bedeutendsten immunogenen Granulozyten-Glykoprotein, dem Fcγ-Rezeptor IIIb (CD16b). Auf dem Rezeptor liegen noch zwei weitere Antigene (HNA-1b und HNA-1c). Autoantikörper gegen Granulozyten erkennen häufig Epitope der HNA-1a-Variante.
HNA-2a (früher NB1) ist auf einem granulozytenspezifischen Glykoprotein lokalisiert, dessen genaue Funktion noch unbekannt ist. Eine Besonderheit dieses Glykoproteins ist seine heterogene Expression, d.h. in einem Individuum existieren nebeneinander zwei Subpopulationen von neutrophilen Granulozyten, solchen, die HNA-2a tragen und anderen, die es nicht tragen.
Antikörper gegen das Antigen HNA-3a (früher 5b) werden oft im Zusammenhang mit schweren Fällen von transfusionsassoziierter akuter Lungeninsuffizienz (TRALI) gefunden. HNA-4a und HNA-5a sind hochfrequente Antigene, die auf Integrinen lokalisiert sind. Sie sind jeweils das Resultat einer Punktmutation.
Literatur: Bux J: Granulocyte immunology. Wien Klin Wochenschr 2001; 113: 799-805.
Nachweis von Antikörpern gegen Granulozyten und Lymphozyten
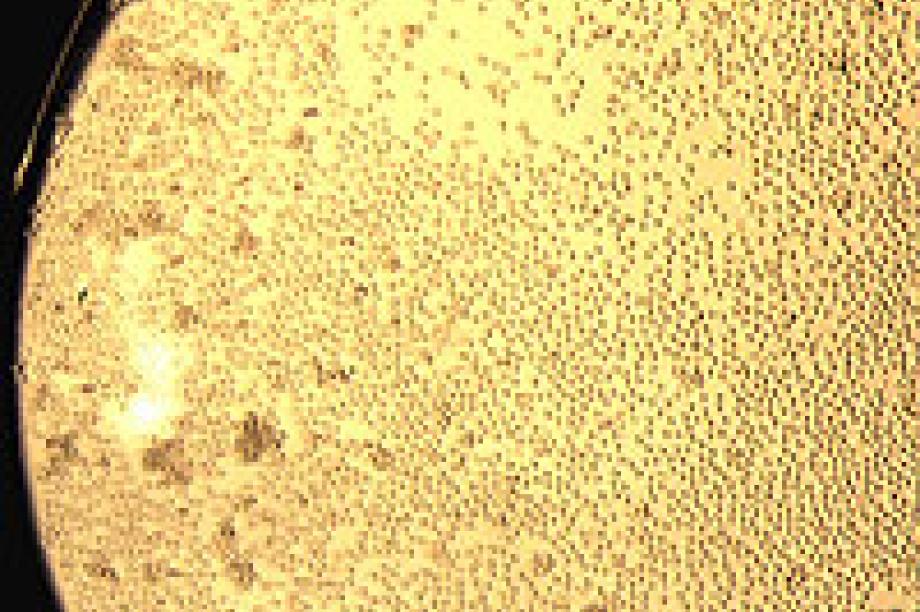
Zum Nachweis von Granulozytenantikörpern hat sich in internationalen Workshops eine Kombination mehrerer Methoden als Goldstandard durchgesetzt. Beim Granulozytenagglutinationstest (GAT) nutzt man die Fähigkeit granulozytärer Antikörper, (Test-)Granulozyten direkt zu aggregieren, d.h. „Agglutination“ ist eigentlich nicht die korrekte, jedoch historisch gewachsene Bezeichnung. In diesem Test werden Testgranulozyten mit dem zu untersuchenden Serum auf einer Mikrotiterplatte inkubiert. Die Aggregation benötigt einige Stunden und wird an einem Umkehrmikroskop beurteilt. Insbesondere Antikörper gegen das Antigen HNA-3a, das eine bedeutende Rolle bei der Auslösung einer TRALI-Reaktion spielt, lassen sich in diesem Test am besten nachweisen.
Andererseits induzieren nicht alle Granulozytenantikörper eine Aggregation. Im Granulozytenimmunfluoreszenztest (GIFT) werden daher mit Hilfe eines fluoreszenzmarkierten Sekundärantikörpers membrangebundene Antikörper nachgewiesen. Die Auswertung erfolgt mittels Durchflußzytometer oder im Fluoreszenzmikroskop. Die Auswertung mit dem Fluoreszenzmikroskop ist zwar aufwendiger und benötigt viel Erfahrung, ist aber nach den Ergebnissen der Internationalen Workshops für Granulozytenimmunologie vorzuziehen. Die Mikroskopie ermöglicht es nämlich im Gegensatz zur Durchflußzytometrie, falsch positive Fluoreszenzsignale, die von zerstörten Zellen stammen, als solche zu erkennen. Ferner kann man im Mikroskop durch das Fluoreszenzmuster häufig membrangebundene Granulozytenantikörper von einer unspezifischen Anlagerung von Immunkomplexen über Fcγ-Rezeptoren unterscheiden. Der GIFT lässt durch die Wahl des Sekundärantikörpers auch die Unterscheidung zwischen IgG-, IgM- und IgA-Antikörpern zu.
Um schließlich granulozytenspezifische Antikörper von HLA-Antikörpern unterscheiden zu können, wird noch ein Lymphozytenimmunfluoreszenztest (LIFT) durchgeführt. Der Testaufbau ist dem GIFT analog, die Auswertung erfolgt hier mittels Durchflußzytometer, da die Lymphozyten sehr stabil sind und in der Mehrzahl keine Fc-Rezeptoren tragen. Die hierzu notwendigen typisierten Testzellen müssen wegen ihrer kurzen Haltbarkeit in vitro für die Untersuchungen jeweils frisch aus Spenderblut isoliert werden. Die Antigenspezifität der in den Suchtests identifizierten Antikörper wird, wenn möglich, in einem glykoproteinspezifischen ELISA (Monoclonal Antibody Immobilization of Granulocyte Antigens = MAIGA) bestimmt. Dies ist prinzipiell mit allen Antigenen bzw. zugrundeliegenden Proteinen möglich, für die monoklonale Antikörper zur Immobilisation des Antigens an die Mikrotiterplatte zur Verfügung stehen (HNA-1, -2a, -4a, -5a). Lediglich HNA-3a-Antikörper können nicht nachgewiesen werden, weil keine monoklonalen Antikörper zur Verfügung stehen. Da der ELISA sehr aufwendig ist, eignet er sich nicht als Antikörpersuchtest.
Literatur: Bux J: Challenges in the determination of clinically significant granulocyte antibodies and antigens. Transf Med Rev X No. 3 : 222-232, 1996; Bux J, Kober B, Kiefel V, Mueller-Eckhardt C: Analysis of granulocyte-reactive antibodies using an immunoassay based upon monoclonal antibody-spec. immobilization of granulocyte antigens (MAIGA). Transf Med 1993; 3:157-162.
Primäre Autoimmunneutropenie
Im Gegensatz zur sekundären Form tritt die primäre Autoimmunneutropenie (AIN) nicht im Gefolge einer bereits bestehenden Grunderkrankung auf. Am häufigsten wird sie bei Kindern im Alter von 5-15 Monaten diagnostiziert, kann jedoch schon bei ein Monat alten Säuglingen auftreten. Mit zunehmendem Lebensalter tritt die AIN seltener auf. Die Inzidenz liegt bei 1 Fall auf 100.000 Einwohner und ist damit zehnmal höher als die der angeborenen Granulozytopenie (Kostmann-Syndrom u.a.). Warum die Patienten granulozytäre Autoantikörper bilden, ist unklar. Eine vorausgehende Infektion, wie sie häufig bei der kindlichen ITP beobachtet wird, ist für die AIN nicht typisch. Die Patienten leiden an rekurrierenden Infekten. Meist handelt es sich um milde Infektionen wie eine Mittelohrentzündung, schwerwiegende Infektionen wie eine Pneumonie, Meningitis oder Sepsis treten bei 5% der betroffenen Kinder auf.
Allerdings können durch das wiederholte Auftreten auch milde Infektionen zu einer bleibenden Beeinträchtigung des Patienten, z. B. Taubheit, führen. Die Erkrankung zeigt einen selbstlimitierenden Verlauf mit einer Spontanremission nach 1 bis 2 Jahren Dauer. In ca. 5-10% der Fälle bleibt die Spontanremission aus, und die AIN besteht über das 3. Lebensjahr hinaus. Bei diesen Patienten persistiert die AIN häufig sehr lange, unter Umständen lebenslang. Allerdings nimmt mit zunehmender Ausreifung des Immunsystems die Infektionsrate ab. Bei erwachsenen Patienten wird deshalb die primäre AIN nicht selten mehr zufällig entdeckt, wenn z. B. im Rahmen einer Operationsvorbereitung ein Differentialblutbild gemacht wird. Im Gegensatz zur primären AIN im Kleinkindesalter sind Spontanremissionen bei Erwachsenen eher die Ausnahme. Die Behandlung besteht im Kindesalter in der prophylaktischen Gabe eines Antibiotikums; bei ernsten Infektionen oder anstehenden Operationen mit hohem Infektionsrisiko wurde G-CSF (5 µg/kg KG) mit Erfolg eingesetzt. Eine dauerhafte Gabe von G-CSF ist jedoch, von Ausnahmen abgesehen, nicht indiziert. Im Erwachsenenalter ist gewöhnlich eine symptomatische Behandlung der auftretenden Infektionen ausreichend.
Immunhämatologische Diagnostik:
Kinder: mindestens 2 ml EDTA-Blut
Erwachsene: mindestens 7 ml EDTA Blut
Literatur:Bux J, Behrens G, Jäger G, Welte K: Primary autoimmune neutropenia in infancy: Analysis of 240 cases. Blood 91:181-186, 1998; McCullough J, Clay ME, Thompson HW. Autoimmune granulocytopenia. Baillière`s Clinical Immunology and Allergy 1987;1:303-326. Lalezari P, Khorshidi M, Petrosova M. Autoimmune neutropenia of Infancy. J Pediatr 1986;109:764-9.
Fallbeispiel primäre Autoimmunneutropenie
Geöffnet Konfigurationseinstellungen
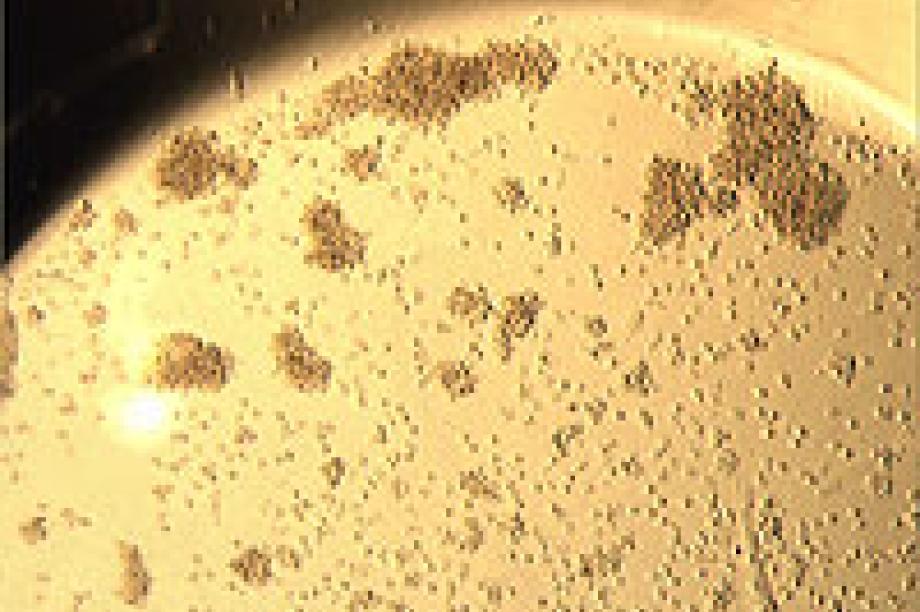
Ein 1-jähriges Mädchen hat schon mehrere Mittelohrentzündungen durchgemacht. Die Zahl der neutrophilen Granulozyten im Blut liegt unter 500/µl. Im Plasma der Patientin können Autoantikörper nachgewiesen werden, die bevorzugt mit HNA-1a-positiven neutrophilen Granulozyten reagieren.
Granulozytenimmun- fluoreszenztest:
HNA-1a-positive Testgranulozyten + Patientenserum
Diagnose:
Primäre Autoimmunneutropenie. Die Spezifität der Autoantikörper für das HNA-1a-Antigen ist typisch für diese Erkrankung.
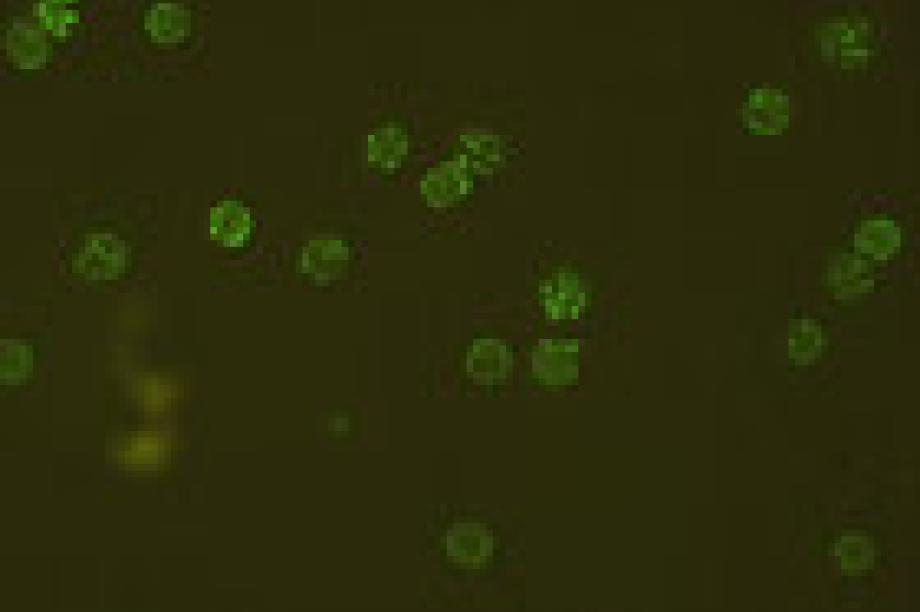
Sekundäre Autoimmunneutropenie (Medikament-induzierte AIN)
Diese tritt im Gefolge einer bereits bestehen Grunderkrankung auf. Typischerweise sind dies Autoimmunerkrankungen wie die Immunthrombozytopenie und/oder die Autoimmunhämolytische Anämie, der systemische Lupus erythematodes, die rheumatoide Arthritis, das Felty-Syndrom oder Malignome wie Lymphome und Leukämien oder Infektionskrankheiten wie die Epstein-Barr-Virus-Infektion. Zu den sekundären Formen zählt man auch die durch Medikamente (β-Lactam-Antibiotika, Analgetika, Malariamittel, Thyreostatika u. a.) ausgelöste AIN. (Medikament-induzierte AIN)
Immunhämatologische Diagnostik:
Kinder: mindestens 2 ml EDTA-Blut,
Erwachsene: mindestens 7 ml EDTA Blut.
Literatur:Stroncek DF. Drug-induced immune neutropenia. Transfusion Medicine Reviews 1993;7:268-274; Shastri A, Logue GL. Autoimmune neutropenia. Blood 1993;81:1984-1995; Bux J, Kissel K, Nowak K, Spengel U, Mueller-Eckhardt C: Autoimmune neutropenia: clinical and laboratory studies in 143 patients. Annals of Hematology 63:249-252, 1991.
Neonatale Immunneutropenie (NIN)
Die neonatale Immunneutropenie (NIN) wird gewöhnlich durch granulozytäre Alloantikörper der Mutter hervorgerufen, die sie während der laufenden oder bei vorausgegangenen Schwangerschaften gebildet hat. In seltenen Fällen können auch mütterliche Autoantikörper zu einer Neutropenie des Neugeborenen führen. Die Alloantikörper sind gegen ein Antigen gerichtet, das die Mutter selbst nicht auf ihren Granulozyten exprimiert. Die Antikörper treten während der Schwangerschaft diaplazentar von der Mutter auf den Feten über, wo sie zu einem vermehrten Abbau der peripheren fetalen Granulozyten führen. Die Inzidenz liegt bei ca. 1:2000 Geburten.
In utero sind die neutropenischen Feten noch vor Infektionen geschützt, die sich nach Geburt häufig zunächst in einer Nabelentzündung und/oder bakteriellen Hautentzündung manifestieren. Bei etwa 20% der Neugeborenen kommt es zu schwerwiegenden Infektionen. Bei nachfolgenden Kindern vom gleichen Vater schwankt die Auftretenshäufigkeit zwischen 50 und 100%. Bei einem Neugeborenen mit NIN sollte eine Infektprophylaxe mit einem Antibiotikum eingeleitet werden. Üblicherweise bildet sich die Granulozytopenie nach 1-2 Monaten spontan zurück. In seltenen Fällen kann sie jedoch bis zu 6 Monaten anhalten. Verantwortlich hierfür werden die verminderte Knochenmarkreserve des Neugeborenen sowie die Schädigung von myelopoetischen Vorläuferzellen durch bestimmte Alloantikörper (v.a. Anti-HNA-2a) gemacht. Die Gabe von G-CSF führt häufig zu einem raschen Anstieg der Granulozytenzahl.
Immunhämatologische Diagnostik:
Neugeborenes: mindestens 1 ml EDTA-Blut,
Mutter: 10 ml Nativblut („Serumröhrchen“) + mindestens 7 ml EDTA-Blut
Vater: mindestens 3 ml EDTA-Blut (Blutbildröhrchen)
Literatur:Bux J, Jung KD, Kauth T, Mueller-Eckhardt C: Serological and clinical aspects of granulocyte antibodies leading to alloimmune neonatal neutropenia. Transfusion Medicine 2:143-149, 1992. Lalezari P. Alloimmune neonatal neutropenia. Baillière`s Clinical Immunology and Allergy 1987;1:443-452.
Transfusionassoziierte akute Lungeninsuffizienz (TRALI)
Die transfusionsassozierte akute Lungeninsuffizienz ist eine seltene, jedoch oft lebensbedrohlich verlaufende Transfusionsreaktion. Die typische TRALI-Reaktion ist gekennzeichnet durch eine während oder innerhalb von 6 Stunden nach Transfusion akut auftretende Atemnot sowie ein beidseitiges in der Röntgenthoraxaufnahme nachweisbares Lungenödem. Eine den Befund erklärende kardiogene Ursache oder Volumenüberladung liegt nicht vor.
Etwa 80% der typischen TRALI-Reaktionen werden durch granulozytenreaktive Antikörper (HLA-Antikörper, granulozytenspezifische Antikörper) ausgelöst: immunogene TRALI-Reaktion. Die Antikörper liegen in der Regel beim Spender vor und wurden dem Patienten mit Plasma- oder Thrombozytenpräparaten transfundiert. Die transfundierten Antikörper aktivieren und/oder agglutinieren die Granulozyten des Empfängers, die im Kapillarbett der Lungenstrombahn hängen bleiben. Dort setzen die aktivierten Granulozyten toxische Enzyme und Sauerstoffradikale frei, die das Kapillarendothel schädigen mit der Folge eines Plasmaübertritts in das Interstitium. In seltenen Fällen wird der ursächliche Antikörper vom Patienten gebildet, der dann mit den transfundierten Granulozyten reagiert, z. B. bei Granulozytentransfusionen oder bei Transfusion nicht-leukozytendepletierter Blutprodukte.
In etwa 20% der typischen TRALI-Fälle kann man keine leukozytären Antikörper nachweisen. Nicht-immunogene TRALI-Reaktion. Man nimmt an, dass diese Fälle durch Zytokine, biologisch aktive Lipide und andere Mediatoren hervorgerufen werden, wie sie bei Lagerung von zellulären Blutprodukten entstehen können. Dass TRALI-Reaktionen nicht regelhaft bei Vorliegen von leukozytären Antikörpern oder granulozytenaktivierenden Mediatoren auftreten, liegt daran, daß die Patienten für die Entwicklung der TRALI-Reaktionen disponiert sein müssen („two hit model“). Dabei entspricht dem „first hit“ ein schweres Trauma, eine Operation, eine Infektion oder eine fortgeschrittene chronische Erkrankung. Der „second hit“ besteht dann in der Transfusion eines Blutproduktes, das Antikörper gegen Leukozyten enthält. So treten TRALI-Reaktionen zumeist bei transfundierten Unfallverletzten, intra- oder postoperativ sowie auf Intensivstationen auf.
Immunhämatologische Diagnostik:
10 ml Nativblut („Serumröhrchen“) und mindestens 5 ml EDTA-Blut vom Patienten sowie allen involvierten Blutspendern bzw. Proben von allen involvierten Blutprodukten.
Literatur:Bux J. Transfusion-related acute lung injury: a neglected but life-threatening transfusion reaction. Infusion Therapy and Transfusion Medicine 2002;29:271-276; Popovsky MA. Transfusion-related acute lung injury. Current Opinion in Hematology. 2000;7:402-407.